Brustkrebs
| Klassifikation nach ICD-10 | |
|---|---|
| C50 | Mammakarzinom |
| C50.0 | Brustwarze und Warzenhof |
| C50.1 | Zentraler Drüsenkörper der Brustdrüse |
| C50.2 | Oberer innerer Quadrant der Brustdrüse |
| C50.3 | Unterer innerer Quadrant der Brustdrüse |
| C50.4 | Oberer äußerer Quadrant der Brustdrüse |
| C50.5 | Unterer äußerer Quadrant der Brustdrüse |
| C50.6 | Recessus axillaris der Brustdrüse |
| C50.8 | Brustdrüse, mehrere Teilbereiche überlappend |
| C50.9 | Brustdrüse, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |

Brustkrebs (medizinisch Mammakarzinom) ist der häufigste bösartige Tumor der Brustdrüse des Menschen. Er kommt hauptsächlich bei Frauen vor; nur etwa jeder hundertste Betroffene dieser Krebserkrankung ist männlich[1]. In den westlichen Staaten ist Brustkrebs die häufigste Krebsart bei Frauen und verursacht auch die meisten Krebstodesfälle in der weiblichen Bevölkerung. Es gibt sowohl erbliche als auch erworbene Risikofaktoren; die meisten Erkrankungen sind jedoch sporadisch (zufällig). Neben der Heilung ist der Erhalt der betroffenen Brust erklärtes Ziel der medizinischen Behandlung. Die Therapie besteht in der Regel in einer an das Erkrankungsstadium angepassten Kombination aus Operation sowie Chemo-, Hormon- und Strahlentherapie. Neue Ansätze werden außerdem durch monoklonale Antikörper ermöglicht. Das medizinische Vorgehen ist in hohem Maß evidenzbasiert und weltweit in Leitlinien standardisiert. Zahlreiche nationale und internationale Programme zur Früherkennung und zur strukturierten Behandlung sollen die Mortalität (Sterblichkeit) künftig senken.
Epidemiologie

In Deutschland ist das Mammakarzinom mit einem Anteil von 28 % aller Krebsneuerkrankungen die häufigste Krebserkrankung bei Frauen. Jede achte bis zehnte Frau erkrankt im Laufe ihres Lebens an Brustkrebs. Dies sind in Deutschland etwa 57.000 Neuerkrankungen pro Jahr oder 130 Fälle pro 100.000 Einwohner und Jahr. Bei internationalen Vergleichen muss die unterschiedliche Altersverteilung der nationalen Bevölkerungen berücksichtigt werden. Die nach dem sogenannten Europastandard (ESR) altersstandardisierte Inzidenz (Neuerkrankungsrate) liegt in Deutschland bei 102/100.000, nach dem Weltstandard (WSR) bei 80/100.000. Die brustkrebsbedingte Sterberate (Mortalität) beträgt 42/100.000 Frauen beziehungsweise altersstandardisiert 27,6/100.000 nach dem ESR und 22/100.000 nach dem WSR. Die Wahrscheinlichkeit, dass eine Erkrankung tödlich ausgeht (Letalität), liegt über alle Stadien gemittelt bei ca. 30 %[2]. Seit 1970 haben sich die Erkrankungszahlen verdoppelt, während die Mortalität eher rückläufig ist [3].
In der westlichen Welt ist Brustkrebs die häufigste Todesursache bei Frauen zwischen dem 30. und 60. Lebensjahr. Weltweit gibt es nach Schätzungen der WHO (2003) zirka 1.050.000 neue Erkrankungsfälle pro Jahr, davon 580.000 in den Industriestaaten. Vergleichsweise seltener ist die Erkrankung in Afrika und Asien. Weltweit starben 1998 ca. 412.000 Frauen an Brustkrebs, das sind 1,6 % aller weiblichen Todesfälle [4].
Männer erkranken selten an Brustkrebs. Nach Schätzungen sind in Deutschland etwa 400 Männer im Jahr betroffen. Das Verhältnis von Erkrankungen bei Männern zu Frauen liegt bei 1:100 [5]. Im Schnitt erkranken sie 10 Jahre später als Frauen. Die Mortalität bei Männern liegt bei rund 200 Todesfällen pro Jahr.
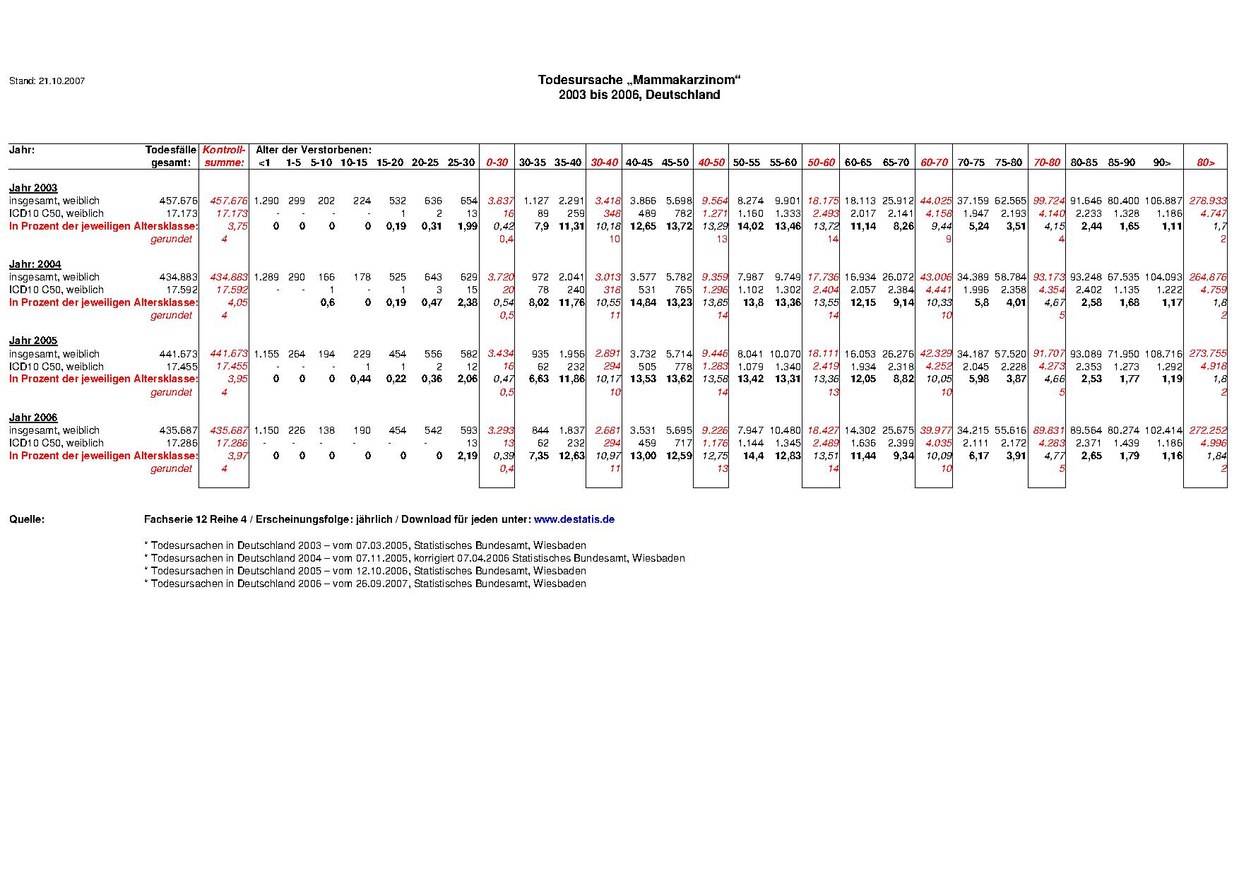
| Anzahl der am Mammakarzinom verstorbenen Frauen nach Altersgruppen [6] | ||||
| Alter | 2003 | 2004 | 2005 | 2006 |
|---|---|---|---|---|
| 0–30 | 1) 16 | 2) 20 | 16 | 13 |
| 30–40 | 348 | 318 | 294 | 294 |
| 40–50 | 1.271 | 1.296 | 1.283 | 1.176 |
| 50–60 | 2.493 | 2.404 | 2.419 | 2.489 |
| 60–70 | 4.158 | 4.441 | 4.252 | 4.035 |
| 70–80 | 4.140 | 4.354 | 4.273 | 4.283 |
| >80 | 4.747 | 4.759 | 4.918 | 4.996 |
| gesamt | 17.173 | 17.592 | 17.455 | 17.286 |
| 1) ein Mädchen 5–10 Jahre 2) ein Mädchen 10–15 Jahre | ||||
| Anteil der Todesursache „Mammakarzinom“ in Prozent nach Altersgruppen (nur Frauen)[6] | ||||
| Alter | 2003 | 2004 | 2005 | 2006 |
|---|---|---|---|---|
| 0-30 | 0,4 | 0,5 | 0,5 | 0,4 |
| 30-40 | 10 | 11 | 10 | 11 |
| 40-50 | 13 | 14 | 14 | 13 |
| 50-60 | 14 | 14 | 13 | 14 |
| 60-70 | 9 | 10 | 10 | 10 |
| 70-80 | 4 | 5 | 4 | 5 |
| 80 > | 2 | 2 | 2 | 2 |
Ursachen und Risikofaktoren
Genetische Risikofaktoren
Etwa 5 % der Brustkrebserkrankungen sind erblich bedingt.[7] Nur bei einer kleinen Gruppe von Frauen (etwa 1 pro 500) findet man definierte, krankheitsverursachende Mutationen. Wesentlich häufiger sind genetische Veränderungen, die die Suszeptibilität (Empfänglichkeit) für Brustkrebs auf äußere Faktoren erhöhen.
Die höchste Wahrscheinlichkeit, an der erblichen Form des Brustkrebs zu erkranken, besteht bei Frauen mit Mutation in den Breast-Cancer-Genen BRCA1 und BRCA2. Es kommt bereits bei einer Mutation in einem Allel dieser Gene zur Erkrankung (man spricht von sogenannten Proto-Onkogenen mit autosomal-dominantem Erbgang). Die Wahrscheinlichkeit, im Laufe des Lebens an Brustkrebs zu erkranken, wird mit 65 % für BRCA1 beziehungsweise 45 % für BRCA2 angegeben.[8]
Mutationen im p53-Gen (einem der Tumorsuppressorgene) werden autosomal rezessiv vererbt. Weitere Genveränderungen mit hohem Risiko betreffen Mutationen von PTEN (Cowden-Syndrom), STK11 (Peutz-Jeghers-Syndrom) und CDH1 (E-Cadherin); deren Häufigkeit und Risiko für die Brustkrebserkrankung ist jedoch nicht genau bekannt. Mäßig erhöht ist das Risiko bei den seltenen genetischen Veränderungen mit mittlerer Penetranz, diese betreffen unter anderem die folgenden Gene: ATM (Ataxia teleangiectatica), CHK2 (checkpoint kinase 2) und BRIP1.[9] Insgesamt gehen nicht mehr als 5 % der Brustkrebserkrankungen auf diese Genveränderungen mit hohem oder mittlerem Risiko zurück.[10]
Die wesentlich häufigeren Allelveränderungen mit geringer Penetranz erhöhen das Brustkrebsrisiko höchstens auf das 1,25-fache bei heterozygoten Veränderungen und auf das 1,65-fache bei homozygoten Veränderungen. Dazu gehören insbesondere Veränderungen von FGFR2 (fibroblast growth factor receptor 2) und auf dem Chromosom 2q. Es wird geschätzt, dass solche Mutationen mit geringer Penetranz bei 58 % der Brustkrebserkrankungen eine Rolle spielen.[11]
Die Wahrscheinlichkeit, selbst zu erkranken, steigt statistisch nachweisbar ab zwei Brustkrebserkrankungen bei direkt Verwandten an [12]. Familien, in denen mehrere Personen an Brust- oder Eierstockkrebs erkrankt sind, wird eine tumorgenetische Beratung in einem Beratungszentrum, beispielsweise aus dem Verbundprojekt familiärer Brustkrebs der Deutschen Krebshilfe empfohlen.[13]
Bei Frauen mit einer entsprechenden Prädisposition (hohe Wahrscheinlichkeit des Krankheitsauftretens) kann auf Wunsch eine beidseitige prophylaktische Mastektomie (Brustamputation) und / oder eine Eierstockentfernung vorgenommen werden: Einen partiellen Schutz vor einer Brustkrebserkrankung scheint die weitgehende Unterbindung der Östrogenproduktion durch die Entfernung beider Eierstöcke zu bieten. Verschiedene Quellen berichten von einer Verringerung des Erkrankungsrisikos von 50 bis 70 %, wenn in der Familie bereits Brustkrebs auftrat.[14]
Hormonelle Faktoren
Weibliche Körperzellen, auch Tumorzellen, tragen Rezeptoren für die Sexualhormone Estrogene und Gestagene. Viele Mammakarzinome werden in ihrem Wachstum durch diese Hormone beeinflusst. Östrogen- und progesteronhaltige Medikamente gegen Wechseljahresbeschwerden (Hormonersatztherapie) erhöhen das Erkrankungsrisiko um bis zu 45 % [15]. Auch Frauen mit früher Menarche (erstes Auftreten der Regelblutung in der Pubertät) und später Menopause (Ende der Menstruation, „Wechseljahre“) tragen ein etwas höheres Erkrankungsrisiko. Kinderlose Frauen erkranken um etwa 30 % häufiger [16]. Frauen, die früh Kinder bekommen und lange stillen, haben dagegen ein niedrigeres Risiko [17].
Ob die Antibabypille das Risiko erhöht, ist substanz- und dosisabhängig und daher nicht vollständig geklärt. Die Nurses' Health Study und weitere Studien haben eine Erhöhung des Risikos auf das 1,2- bis 1,4-fache nach einer Einnahme der „Pille“ über mehr als fünf Jahre gezeigt.
Schwangerschaftsabbrüche erhöhen das Brustkrebsrisiko einer Metaanalyse aus dem Jahr 2004 zufolge nicht [18]. Auch in anderen Studien mit hohen Fallzahlen konnte man einen solchen Zusammenhang nicht nachweisen [19] [20] [21].
Phytoöstrogene sind Pflanzeninhaltsstoffe mit schwach östrogenartiger Wirkung. Ob Diäten, die reich an solchen Stoffen sind (etwa auf Sojabasis) das Erkrankungsrisiko erhöhen oder im Gegenteil durch Interaktion mit der körpereigenen Hormonproduktion senken, ist noch unbekannt, da die Ergebnisse der wissenschaftlichen Untersuchungen widersprüchlich sind [22] [23].
Weitere Faktoren
Die Exposition mit ionisierender Strahlung in jungen Jahren erhöht das spätere Brustkrebsrisiko [24]. Mammographie-Untersuchungen bei Frauen über 40 Jahren führen zu keiner bedeutsamen Risikosteigerung mehr [25].
Auch die Lebensweise beeinflusst das Risiko. So erkranken adipöse Frauen 2,5 mal häufiger als Normalgewichtige [16]. Starkes und langjähriges Zigarettenrauchen erhöht die Erkrankungswahrscheinlichkeit um 30 % [26]. Auch Frauen, die täglich mindestens 20 g Alkohol trinken, haben ein um 30 % erhöhtes Mammakarzinomrisiko, möglicherweise wegen des höheren Sexualhormonspiegels [16]. Ein weiterer möglicher Risikofaktor könnte Sonnen- bzw. Vitamin-D-Mangel sein. Dieser Zusammenhang wird auch für Prostatakrebs, Dickdarmkrebs, Ovarialkrebs, Melanome und Blasenkrebs vermutet [27]. Wenn ältere (postmenopausale) Frauen zur Vorbeugung von Knochenbrüchen Calcium und Vitamin D einnehmen, scheint das Erkrankungsrisiko stark zu sinken [28].
Brustkrebsauslösung durch eine Infektion („Brustkrebsvirus“) wurde bisher nicht nachgewiesen. Brustimplantate verursachen keinen Brustkrebs [29], ebenso wenig wie das Tragen von Büstenhaltern [29].
Früherkennung und Screening
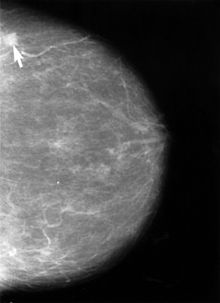
Etwa 80 bis 90 % aller Knoten in der weiblichen Brust wurden bisher von den Frauen selbst zufällig entdeckt. Diese tast- und sichtbaren Tumoren sind bei ihrer Entdeckung oft schon fortgeschritten und haben eine schlechte Prognose. Durch konsequente Früherkennung kleinerer, nicht tastbarer Herde könnte die Sterblichkeit großen Studien zufolge um 25 % gesenkt werden. Zur Früherkennung dienen Programme zur systematischen Selbstuntersuchung sowie die Screening-Mammographie.
Selbstuntersuchung
Systematische Schulungen der weiblichen Bevölkerung zur Brust-Selbstuntersuchung sind in ihrem Nutzen umstritten. Ein fehlender Tastbefund schließt eine Tumorerkrankung nicht aus. Umgekehrt ist nur etwa jede zwölfte selbst ertastete Veränderung bösartig [30]. Studien zufolge senkt die systematische Selbstuntersuchung der Brust die Sterblichkeit nicht [31] [32]. Die US-amerikanische Preventive Services Task Force (USPSTF) gibt wegen der unzureichenden Datenlage keine Empfehlung für oder gegen die Brustselbstuntersuchung [33]. Die kanadische Task Force on Preventive Health Services gab 2001 eine Empfehlung gegen die Selbstuntersuchung ab [34], weil die Entdeckungsrate schlecht und falsch positive Befunde häufig seien.
In Deutschland wird die Selbstuntersuchung von den medizinischen Fachgesellschaften empfohlen [35], weil sie zur Bewußtseinsbildung der Frauen beitrage und so die eigentliche Früherkennung durch apparative Verfahren begünstige. Die Selbstuntersuchung, die monatlich zirka 5 bis 7 Tage nach Einsetzen der Regelblutung durchgeführt werden soll, erfolgt nach einem bestimmten, sich immer wiederholenden Muster. Bei ertasteten Auffälligkeiten sollen sich Frauen bei einem Arzt vorstellen.
Ärztliche Krebsvorsorge
Die klinische Untersuchung der Brust durch einen Arzt ist Bestandteil des gesetzlichen Krebs-Frühuntersuchungsprogramms ab dem 30. Lebensjahr. Für die ärztliche Tastuntersuchung gilt im Prinzip dieselbe Einschränkung wie für die Selbstuntersuchung.
Bildgebende Verfahren

Die Röntgen-Mammographie ist einer S3-Leitlinie (Medizinische Leitlinie der höchsten Qualitätsstufe) zufolge bis jetzt das einzige Verfahren, dessen Eignung zur Erkennung früher Karzinome und Karzinomvorstufen allgemein anerkannt ist [35]. Die Mamma-Kernspintomographie ist möglicherweise überlegen, jedoch für ein Massenscreening zu teuer [36]. In Deutschland wird deshalb ein qualitätsgesichertes Mammographie-Screening-Programm auf der Grundlage der „Europäischen Leitlinien für die Qualitätssicherung des Mammographie-Screenings“ für Frauem von 50–69 Jahren aufgebaut. Insgesamt 94 dieser Einheiten sind bis Ende 2008 in ganz Deutschland geplant. Etwa 84 Regionen bieten das Mammographie-Screening bereits für die Zielgruppe, Frauen zwischen 50 und 69 Jahren, an (Stand Januar 2008) [37] In den USA gibt es die Empfehlung, das Mammographiescreening bereits mit 40 Jahren zu beginnen[33].
Durch Dreifachbefundung und Abklärungsdiagnostik wird erreicht, dass möglichst wenige gutartige Mammatumoren bioptiert oder gar entfernt werden. Die EUREF-Richtlinie verlangt mindestens 50 % bösartige Tumoren bei den Bioptaten; [38] manche Programme erreichen bis zu 80 % [39].
CAD-Systeme (Computer Assisted Detection) können den Radiologen bei der Auswertung der Mammographien unterstützen. Sie sind in den USA und den Niederlanden abrechnungsfähig. Studien zufolge verbessern die bislang verfügbaren Geräte die Erkennungsrate jedoch nicht [40]. In den europäischen Screeningprogrammen wird daher die Doppelbefundung durch zwei Ärzte (und durch einen dritten bei Auffälligkeiten) bevorzugt.
Die Mammographie ist bei Frauen mit dichtem Drüsengewebe in ihrer Aussagekraft begrenzt. Bei extrem dichtem Gewebe werden etwa 50 % der Brusttumoren mammographisch nicht entdeckt. Dies betrifft in erster Linie jüngere Frauen. Frauen mit dichtem Gewebe im Mammogramm wird daher der Einsatz eines zweiten Untersuchungsverfahrens (in der Regel Sonographie, im Einzelfall auch Kernspin-Mammographie) empfohlen.
Diagnose
Klinische Untersuchung
Bei der Selbstuntersuchung oder bei der klinischen Untersuchung beim Frauenarzt kann ein neuer, unscharf begrenzter Knoten auffallen. Weitere Anzeichen sind Verhärtungen, Größen- und Umrissveränderungen der Brust im Seitenvergleich, verminderte Bewegung der Brust beim Heben der Arme, bleibende Hautrötung, Hauteinziehung, oder Apfelsinenhaut (verdickte Haut mit eingezogenen Stellen), Einziehung oder Entzündung der Brustwarze, Absonderungen aus der Brustwarze. Knoten in der Achselhöhle können Lymphknoten-Metastasen entsprechen. Allgemeinsymptome bei weit fortgeschrittenen Erkrankungen sind u. a. Leistungsknick oder Knochenschmerzen.
Bildgebende Diagnostik
Mit der Mammographie werden Sonographie- oder Tastbefunde abgesichert. Die Röntgenaufnahmen werden aus zwei Blickrichtungen (von der Seite und von oben) aufgenommen. Knoten in ungewöhnlicher Lage erfordern manchmal zusätzliche Projektionen. Die Galaktographie wird nur durchgeführt, wenn die Brustwarzen Sekret absondern.
Umgekehrt werden mammographisch gefundene Knoten immer sonographisch nachuntersucht. Dabei werden gutartige Zysten sofort erkannt. Die Leitlinie der Kassenärztlichen Bundesvereinigung schreibt hierfür Schallköpfe mit mindestens 5 MHz Frequenz vor [41].
Die Kernspintomographie der Brust (MR-Mammographie, MRT) wird zur Zeit nur empfohlen für das invasive lobuläre Mammakarzinom zur Abklärung der Resektions-Grenzen und allgemein bei Verdacht auf das Vorliegen mehrerer Tumorherde[42], gegebenenfalls ist auch eine MRT-gesteuerte Biopsie möglich. Nach brusterhaltender Therapie kann die MRT eingesetzt werden, um zwischen narbigen Verdichtungen in der operierten Brust und neuem Tumorwachstum zu unterscheiden. Außerhalb der ambulanten Versorgung der Kassenpatientinnen gibt es weitere Indikationen.
Die Positronen-Emissions-Tomographie ist derzeit keine Routinemethode, kann jedoch in Einzelfällen oder im Rahmen klinischer Studien eingesetzt werden um nach Lymphknotenmetastasen oder nach dem Tumor in der Brust zu suchen, wenn dieser mit anderen Methoden nicht gefunden werden kann.
Knochenszintigramme, Computertomographie, Röntgenaufnahmen der Lunge, Sonographie der Leber und ggf. Kernspintomographie dienen dazu, vor einer Operation nach Metastasen zu suchen.
Gewebeentnahmen
Wurde mit dem Ultraschall und der Mammographie ein Tumor diagnostiziert, wird dieser auf seine Gut- oder Bösartigkeit getestet. Dazu werden jedem Tumor mittels Stanzbiopsie, in seltenen Fällen mittels Vakuumbiopsie, mehrere Gewebeproben entnommen und auf Krebszellen untersucht. Methode der Wahl für die Probenentnahme tastbarer und sonografisch sichtbarer Befunde ist die Stanzbiopsie, für im Kernspintomogramm sichtbare Befunde und Mikrokalzifikationen die stereotaktisch gestützte Vakuumbiopsie. Wurde der Tumor als bösartig erkannt, wird das Karzinom durch weitere Untersuchungen des entnommenen Gewebes näher bestimmt. Hierzu gehören der Status der Hormon- und HER2/neu-Rezeptoren sowie der Entartungsgrad.
Nach der Operation wird das aus der Brustdrüse entfernte Operationspräparat in der histologischen Untersuchung auf seine exakte Größe vermessen und das Gewebe auf einen weiteren, nicht im Vorfeld erkannten Befall untersucht. Die entfernten Lymphknoten werden auf Metastasenbefall überprüft. Die Größe des Karzinoms und die Anzahl der befallenen Lymphknoten sind für die TNM-Klassifikation, Prognose und weitere Behandlung von Bedeutung. Das Operationspräparat wird auch daraufhin vermessen, ob der Abstand zwischen dem Karzinom und dem verbliebenen, gesunden Gewebe ausreichend groß ist. Sollte dies nicht der Fall sein, kann eine Nachoperation nötig werden, damit ein angemessener Sicherheitsabstand zwischen gesundem und erkranktem Gewebe erreicht wird.
Klassifikation


Die Klassifikation eines Tumors ist dessen exakte Beschreibung auf der Grundlage der pathologischen Untersuchung einer Gewebeprobe oder des OP-Präparats und der entnommenen Lymphknoten.
Histologische Klassifikation
Der häufigste Tumortyp des Mammakarzinoms ist ein Adenokarzinom ohne besondere Merkmale; aufgrund der Entstehung aus dem Epithel der Milchgänge wird dieser Tumortyp als invasives duktales Karzinom (IDC) bezeichnet und betrifft etwa 70–80 % aller Mammakarzinome. Seltener (in etwa 10–15 %) sind das invasive lobuläre Karzinom (ILC), das invasive tubuläre, muzinöse, medulläre, papilläre Karzinom (je etwa 2 %), gemischte und andere Tumortypen. Diese Tumortypen unterscheiden sich in ihrer klinischen Präsentation, den bildgebenden Befunden, dem histologischen Ausbreitungsmuster und in der Prognose. Bei fast allen Tumortypen liegt auch eine nicht invasive (duktale oder lobuläre) Tumorkomponente vor, aus der sie hervorgegangen sind und die für die Größe der Operation mitentscheidend ist. Seltener geht das Mammakarzinom direkt aus gutartigen Erkrankungen hervor (von denen einige bei Mammatumor genannt sind, es handelt sich hier aber nicht um Tumorerkrankungen). Das inflammatorische Mammakarzinom ist kein histologischer Tumortyp, sondern eine besondere klinische Manifestation mit Rötung und Schwellung der gesamten Brust und imitiert eine Entzündungsreaktion aufgrund einer massiven Tumorausbreitung im Lymphgefäßsystem.
Die nicht-invasiven Karzinome sind definiert als Karzinome innerhalb der Brustdrüsengänge (duktales Carcinoma in situ, DCIS) oder -läppchen (lobuläres Carcinoma in situ, LCIS) ohne Stromainvasion. Eine Sonderstellung nimmt der Morbus Paget der Brustwarze (Mamille) ein, der auf einer nicht-invasiven Tumorausbreitung in die Mamillenhaut beruht und in der Regel mit einem intraduktalen Mammakarzinom, seltener auch mit einem invasivem Mammakarzinom assoziiert ist. Dieses Paget-Karzinom der Brustwarze kann klinisch mit einem Ekzem oder gutartigen Geschwür verwechselt werden.
Differenzierungsgrad
Die histologischen Tumortypen werden anhand struktureller und zellulärer Eigenschaften sowie ihrer Kernteilungsrate unterteilt in drei Differenzierungsgrade (synonym Malignitätsgrad, englisch auch Grading). Die Einstufung des invasiven Karzinoms beruht auf den drei Kriterien Tubulusbildung (Strukturveränderung der Zellkerne), Kernpolymorphie (Gestalt und Größe der Zellen) und Mitoserate (Teilungsrate der Zellen). Je höher das Grading, desto ungünstiger ist das Verhalten der Tumorzellen. Man unterscheidet Tumoren mit Differenzierungsgrad 1, 2 oder 3 (G1 = gut differenziert, G2 = mäßig differenziert, G3 = gering differenziert).
TNM-Klassifikation
Die TNM-Klassifikation beschreibt die Größe des Tumors (T), die Anzahl der befallenen Lymphknoten (N) und eine eventuelle Fernmetastasierung (M). Die tabellierte Kurzfassung der TNM-Klassifikation für Brustkrebs:
| T Tumorgröße | |
|---|---|
| T0 | kein Tumor nachweisbar |
| Tis | Carcinoma in situ, nicht invasiv |
| T1mic | Mikroinvasion bis 0,1 cm |
| T1 | bis 2 cm |
| T2 | > 2 cm bis 5 cm |
| T3 | > als 5 cm |
| T4 | jede Größe mit Ausdehnung auf die Brustwand oder Haut |
| N Befallene Lymphknoten | |
|---|---|
| N0 | keine |
| N1 | 1-3 in der Achsel |
| N2 | 4-9 in der Achsel |
| N3 | 10 oder mehr in der Achsel oder unter/über dem Schlüsselbein |
| M (Fern-) Metastasen | |
|---|---|
| M0 | keine nachweisbar |
| M1 | nachweisbar (meist Lunge, Leber, Knochen) |
Stadieneinteilung
Aus der TNM-Klassifikation (bzw. pTNM-Klassifikation, das 'p' steht für histologisch gesicherte Daten) des Mammakarzinoms ergibt sich die Stadiengruppierung nach UICC bzw. AJCC (TNM 6. Aufl., 2003) wie folgt:
| Stadium 0 | Tis | N0 | M0 |
| Stadium I | T1 | N0 | M0 |
| Stadium IIA | T0,T1 | N1 | M0 |
| T2 | N0 | M0 | |
| Stadium IIB | T2 | N1 | M0 |
| T3 | N0 | M0 | |
| Stadium IIIA | T0,T1,T2 | N2 | M0 |
| T3 | N1,N2 | M0 | |
| Stadium IIIB | T4 | N0,N1,N2 | M0 |
| Stadium IIIC | Jedes T | N3 | M0 |
| Stadium IV | Jedes T | Jedes N | M1 |
Hormonrezeptor- und HER2-Status
Der Östrogenrezeptor- und Progesteronrezeptorstatus (ER- und PgR-Expression) wird ebenfalls histologisch, genauer immunhistologisch untersucht. Man bestimmt den Prozentsatz positiver Tumorzellen und errechnet aus Prozentsatz und der Färbeintensität einen 12-stufigen Immunreaktiven Score (IRS), oder den international gebräuchlicheren 8-stufigen Allred-Score.
| Färbeintensität (IS) | Positive Zellen (PP) | ||
|---|---|---|---|
| 0 | keine Reaktion | 0 | keine |
| 1 | schwache Reaktion | 1 | weniger als 10 % |
| 2 | mäßige Reaktion | 2 | zwischen 10 und 50 % |
| 3 | starke Reaktion | 3 | zwischen 51 und 80 % |
| 4 | mehr als 80 % | ||
| IRS | |
|---|---|
| 0–2 | negativ |
| 3–4 | schwach positiv |
| 6–8 | mäßig positiv |
| 9–12 | stark positiv |
Beim HER2-Rezeptor, der für die Nachbehandlung mit Trastuzumab ausschlaggebend ist, wird ein 4-stufiger Score angewandt, der sich nach der immunhistochemischen Färbeintensität richtet (ASCO-Empfehlung 2007 [43]). Lassen sich keine Zellen anfärben, ist das Ergebnis negativ: Score 0. Auch der Score 1+ ist negativ, d. h. eine Behandlung mit Trastuzumab wäre ohne Effekt auf den Tumor. Bei einer mittleren Färbeintensität (Score 2) wird der Tumor mit dem FisH-Test nachuntersucht und anhand Vermehrung (Amplifikation) des HER2-Gens entschieden, ob es sich um einen HER2-positiven Tumor handelt.
| Positive Zellen | Membranfärbung | Färbeintensität | Score |
|---|---|---|---|
| keine | keine | keine | 0 |
| 1 % oder mehr | nicht komplett | schwach | 1+ |
| weniger als 10 % | vollständig | schwach bis mäßig | 1+ |
| 10 % oder mehr | vollständig | schwach bis mäßig | 2+ |
| 30 % oder weniger | vollständig | stark | 2+ |
| mehr als 30 % | vollständig | stark | 3+ |
St.-Gallen-Risikogruppen
Die alle zwei Jahre in St. Gallen abgehaltene Konsensuskonferenz beschäftigt sich vor allem mit der adjuvanten Therapie. Um die Chemo- und Hormontherapie möglichst zielgerecht einsetzen zu können, werden der Empfehlung von 2007 folgend die operierten Patientinnen in drei Risikogruppen eingeteilt [44]:
| Niedriges Risiko | Mittleres Risiko | Hohes Risiko | |
|---|---|---|---|
| Anzahl der befallenen Lymphknoten: |
keiner | 1 bis 3 oder keiner, aber 1 weiteres Kriterium: |
mehr als 4 oder 1 bis 3 und |
| Tumorgröße: | T1 (max. 2 cm) | T2 bis T4 (größer als 2 cm) | |
| Differenzierung: | G1 | G2 und G3 | |
| Tumoreinbruch: | Invasion in Gefäße | ||
| Hormonstatus: | ER/PR-positiv (Östrogen-/Progesteron-positiv) | ||
| HER2/neu-Status: | HER2/neu-negativ | HER2/neu-positiv | HER2/neu-positiv |
| Alter: | 35 Jahre und älter | oder jünger als 35 Jahre |
Molekulare Tumorklassifikation
Anhand des Genexpressionsprofils, welches mit DNA-Microarrays aus dem Tumorgewebe gewonnen werden kann, kann man fünf verschiedene Hauptgruppen des Mammakarzinoms unterscheiden: Hormonrezeptorpositive Tumoren mit geringer bzw. höherer Aggressivität (genannt Luminal-A und Luminal-B), HER2-positive Tumoren (erbB2-Phänotyp) und Hormonrezeptor- und HER2-negative Karzinome mit oder ohne Basalzell-Eigenschaften (basal-like und normal-like Phänotypen). Die zur Zeit noch experimentelle molekulare Tumorklassifikation könnte in Zukunft eine besseren Abschätzung der Prognose und der voraussichtlichen Wirkung der adjuvanten Hormon- und Chemotherapie ermöglichen [45].
Therapie
Zur Vereinheitlichung und flächendeckenden Verbesserung der Krankenversorgung gibt es in Deutschland seit 2003 im Auftrag der DKG und der Deutschen Gesellschaft für Senologie von OnkoZert zertifizierte Brustzentren an Krankenhäusern[46] und seit 2004 ein Disease-Management-Programm für Brustkrebs[47], an dem sich auch niedergelassene Ärzte beteiligen können. Die gemeinsame Leitlinie der Stufe S3 der Deutschen Krebsgesellschaft und der medizinischen Fachgesellschaften ist für diese Programme die Orientierung zur Behandlung von Brustkrebs. Diese Leitlinie wird regelmäßig aktualisiert, zuletzt im Februar 2008.[42]
Die Strategie zur Brustkrebsbehandlung wird meist im Rahmen einer Tumorkonferenz geplant, an der sich Gynäkologen, internistische Onkologen, Radiologen, Strahlentherapeuten und Pathologen beteiligen. Die Einbindung der Patientin in die Entscheidungsfindung ist wie bei jeder eingreifenden medizinischen Maßnahme von großer Bedeutung (siehe informierte Einwilligung). Auch der deutsche Gesetzgeber spricht in der DMP-Richtlinie deutlich vom Status der aufgeklärten Patientin [48].
Die Brustkrebstherapie soll im Frühstadium eine Heilung, beim metastasierten Karzinom eine Lebenszeitverlängerung und im Spätstadium eine Linderung der Krankheitsbeschwerden erreichen. Bei der Wahl der konkreten Therapie wird die Erhaltung der Lebensqualität in den Vordergrund gestellt [48][42]. Darum wird neben den weiter oben beschriebenen Klassifikationen des Tumors auch die körperliche, psychosoziale und emotionale Situation der Patientin berücksichtigt. Eine „Standardtherapie“ gibt es nicht mehr, da all diese Faktoren die Brustkrebstherapie immer individueller gestalten [48][42].
Brustkrebs breitet sich sehr schnell im Körper aus und muss daher schon in frühen Stadien mit einer systemischen (im ganzen Körper wirksamen) Therapie behandelt werden. Diese nach dem amerikanischen Chirurgen Bernard Fisher benannte „Fisher-Doktrin“ ist die Grundlage der Chemo- und Hormontherapie beim Brustkrebs[49]. Fast immer besteht die Therapie heute aus einer Kombination verschiedener Modalitäten. Die vor der Operation eingesetzten Verfahren werden neoadjuvant genannt, die nach dem chirurgischen Eingriff angeschlossene Behandlung adjuvant.
Neoadjuvante Therapie
In einigen Fällen wird eine Chemotherapie oder antihormonelle Therapie schon vor der chirurgischen Entfernung des Tumors durchgeführt [50]. Diese primäre, oder neoadjuvante Therapie hat zum Ziel, den Tumor zu verkleinern und eine Entfernung, oder sogar brusterhaltende Operation zu ermöglichen. Standard ist die neoadjuvante Therapie beim inflammatorischen Karzinom und bei zunächst inoperablen Tumoren. Die Chemotherapieschemata sind die gleichen wie bei der postoperativen Behandlung (siehe unten).
Operation
Brusterhaltende Chirurgie vs. Mastektomie

Eine brusterhaltende Therapie (BET) ist heute in 60–70 % der Erkrankungsfälle möglich [51], wenn die Relation zwischen der Tumorgröße und dem Brustvolumen günstig und der Tumor noch nicht in die Muskulatur oder Haut eingebrochen ist. Bei dieser Operation wird entweder der Tumor mit dem umliegenden Gewebe, ein größeres Segment oder ein ganzer Quadrant entfernt. Um ein kosmetisch ansprechendes Ergebnis zu erhalten, wird bei größerer Gewebeentfernung vor allem aus beiden unteren Quadranten die sogenannte intramammäre Verschiebeplastik vorgenommen. Dabei wird die Brustdrüse ganz oder teilweise von Haut und Muskulatur gelöst und so verschoben, dass nach der Operation trotz des fehlenden Gewebes eine ausgeglichene Brustform zurück bleibt. Ist eine Verschiebeplastik nicht möglich, wird die Brust entweder direkt nach der Tumorentfernung oder nach Abschluss aller Behandlungen rekonstruiert.
Sollte eine Brusterhaltung nicht möglich sein, wird der gesamte Brustdrüsenkörper amputiert (Ablatio, Mastektomie). Die Empfehlung zur Mastektomie wird ausgesprochen, wenn:
- der Tumor sehr groß ist (> 3 cm) oder den Brustmuskel infiltriert hat,
- ein inflammatorisches Karzinom diagnostiziert wurde,
- ein ausgedehnter Einbruch in die Lymphgefäße der Brustdrüse nachgewiesen wurde,
- der Tumor ausgedehnte „Arme“ in die Milchgänge gebildet hat,
- die gesamte Brustdrüse eine durch die Mammographie nachgewiesene, unklare Mikroverkalkung enthält,
- der Tumor trotz Nachoperation nicht mit einem ausreichenden Sicherheitsabstand zum gesunden Gewebe entfernt werden konnte,
- die Patientin dies wünscht. Manche Patientinnen entscheiden sich gegen die Möglichkeit zur brusterhaltenden Operation, um sich sicherer zu fühlen, oder um die sonst notwendige Strahlentherapie zu vermeiden.
Die Empfehlung zur Mastektomie wird auch ausgesprochen, wenn ein multizentrisches (Tumorknoten in mehreren Quadranten) oder multifokales (mehrere Tumorknoten im selben Quadranten) Karzinom diagnostiziert wurde. Diese Empfehlung kann in ausgewählten Fällen relativiert werden, wenn der Operateur alle Tumore mit einem ausreichenden Sicherheitsabstand zum gesunden Gewebe entfernen kann [52] [53]. Auch ein bereits in entfernt liegende Organe metastasierter Tumor kann schonend operiert werden, wenn das radikale chirurgische Vorgehen keinen Vorteil mehr bringen würde.
Achsellymphknoten
Die Lymphknoten der Achsel sind meist der erste Ort, an dem sich Metastasen bilden. Um diesen Befall zu erfassen, werden die Lymphknoten bei der Operation in der Regel mit entfernt.
Um die Folgeschäden (Lymphödem) so gering wie möglich zu halten, kann zunächst nur ein einzelner Lymphknoten entfernt und untersucht werden, wenn der Tumor in der Brust kleiner als 2 cm ist und die Achsellymphknoten nicht tastbar sind [54]. Dazu wird in die betroffene Brust ein Farbstoff oder ein Radionuklid injiziert, um den Lymphabfluss darzustellen. Der erste speichernde Lymphknoten wird herausoperiert und untersucht. Nur wenn dieser sogenannte Wächterlymphknoten (sentinel node) von Tumorzellen befallen ist, werden die übrigen Lymphknoten der Achselhöhle ebenfalls entfernt. Auch wenn der Wächterlymphknoten nur von einer Mikrometastase befallen ist, wird zur Zeit eine Ausräumung der Achselhöhle empfohlen. Ob diese Operation einen Behandlungsvorteil mit sich bringt, wurde noch nicht mit einer Studie belegt (Stand 2/2008).
Adjuvante Therapie
Fast alle Patientinnen erhalten nach der Operation eine adjuvante (unterstützende) Behandlung, um das Ergebnis abzusichern.
Chemotherapie
Nach der Operation folgt für die meisten Patientinnen eine Chemotherapie, um verbliebene Tumorzellen zu vernichten. Welche Medikamente verabreicht werden, hängt vom Zustand der Patientin und von der Klassifikation des Tumors ab, vor allem von der Risikogruppe nach der St.-Gallen-Empfehlung. Die Behandlung wird in mehreren Zyklen durchgeführt, beispielsweise insgesamt viermal im Abstand von drei Wochen, oder sechsmal in Abstand von zwei Wochen. Der Zeitabstand zwischen den einzelnen Gaben soll dem Körper einerseits die Gelegenheit zur Regeneration gegeben, andererseits hofft man darauf, dass Mikrometastasen (ruhende Tumorzellen) bzw. Krebsstammzellen in den Erholungsphasen mit der Teilung beginnen und mit der erneuten Zuführung der Zytostatika zerstört werden können.
In der Regel werden die Zytostatika als Kombinationen eingesetzt. Die häufigsten Schemata sind zur Zeit AC oder EC, FAC oder FEC. Wenn die Lymphknoten mit Metastasen befallen waren, wird eine Ergänzung der jeweiligen Kombination mit Taxanen empfohlen (St. Gallen, 2007). Das ältere CMF-Schema wird kaum noch verwendet. (A = Adriamycin, C = Cyclophosphamid, E = Epirubicin, F = Fluorouracil, M = Methotrexat, T = Taxane)
Bei HER2/neu-positiven Tumoren wird in der Regel nicht auf eine Chemotherapie verzichtet, da die Therapie mit Trastuzumab zur Zeit nur als ergänzende Behandlung verstanden wird („Antikörper-Therapie“, siehe unten). Die Dauer und die Zusammensetzung der Chemotherapie wird vom Ausmaß der befallenen Lymphknoten mit bestimmt (St. Gallen 2007).
Wenn der Tumor hormonabhängig und die Lymphknoten frei von Metastasen sind, kann unter Umständen auf eine Chemotherapie verzichtet werden. Bei diesem Status können mit einer antihormonellen Therapie ähnliche Ergebnisse erzielt werden (St. Gallen 2007).
Bestrahlung
Nach der brusterhaltenden Operation sollte eine Strahlentherapie der Restbrust erfolgen[42]. Sie senkt die Rezidivrate von 30 auf unter 5 %. Mikroskopische (nicht mit bloßem Auge erkennbare) Tumorreste können in der Brustdrüse verblieben sein.
Auch nach einer Mastektomie wird zur Nachbestrahlung geraten, wenn der Tumor größer als 5 cm war, die Brustdrüse mehrere Tumore enthielt oder der Tumor bereits in Haut oder Muskulatur eingebrochen war. Auch der Befall von Lymphknoten ist ein Anlass zur Nachbestrahlung der Brustwand, insbesondere bei mehr als drei befallenen Lymphknoten.
Das ehemalige Tumorgebiet soll bei Frauen unter 60 Jahren mit einer um 10-16 Gy höheren Dosis bestrahlt werden, damit sich an den Schnitträndern keine Rezidive ansiedeln können.
Die Strahlentherapie beginnt zirka 4–6 Wochen nach der Operation und dauert sechs bis acht Wochen.
Antihormonelle Therapie
Ist das Karzinom hormonsensitiv, wird zusätzlich eine Therapie mit Hormonantagonisten durchgeführt. Es gibt dafür Varianten abhängig vom menopausalen Status der Frau.
Vor der Menopause:
Eine chirurgische Ovariektomie oder radiotherapeutische Ausschaltung der Ovarfunktion wird nur noch selten vorgenommen. Studien zufolge genügt eine temporäre Ausschaltung der Hormonproduktion über zwei Jahre, die medikamentös erreicht werden kann [50].
Bei Frauen, die noch die Periode haben, wird schon durch Chemotherapie die Hormonfunktion der Eierstöcke gestört [55]. Dieser Effekt richtet sich auch gegen die hormonabhängigen Tumorzellen und sind daher erwünscht. Frauen mit Kinderwunsch oder Frauen, denen das Risiko einer vorzeitigen Menopause zu groß ist[56], können ihre Eierstöcke mit GnRH-Analoga (die die ovariale Produktion von Östrogen und Progesteron unterdrücken) vor der schädigenden Wirkung schützen und gleichzeitig die Hormonausschaltung bewirken. GnRH-Analoga werden in der Regel über zwei Jahre gegeben [50].
Nach der Chemotherapie wird normalerweise ein Estrogen-Rezeptor-Modulator wie Tamoxifen, welcher die Anbindung des körpereigenen Östrogens an den Östrogen-Rezeptoren des Tumors verhindert, für 5 Jahre gegeben [57]. Aromatasehemmer sind vor der Menopause nicht angezeigt.
Nach der Menopause:
Ist die Patientin postmenopausal, erhält sie für in der Regel fünf Jahre entweder Tamoxifen oder einen Aromatasehemmer, welcher durch eine Enzymblockade die Bildung von Östrogen im Muskel- und Fettgewebe unterbindet. Neuere Studien deuten an, dass die Aromatasehemmer wirksamer sind als das Tamoxifen, das heißt, das krankheitsfreie Überleben steigt an. In Studien wird der Aromatasehemmer manchmal sofort verwendet (upfront), in der Regelbehandlung erst nach zwei bis drei Jahren unter Tamoxifen (switch), oder nach fünf Jahren (extended) [50]. Die jeweiligen Nebenwirkungen der Substanzen müssen bei der Entscheidung berücksichtigt werden. Eine weitere Möglichkeit besteht in der Gabe eines reinen Estrogen-Rezeptor-Antagonisten.
Bei vielen Patientinnen mit hormonabhängigen Tumoren verliert Tamoxifen nach einigen Jahren seine Schutzwirkung (sogenannte Tamoxifenresistenz). Laborversuchen zufolge kann im Gegenteil sogar eine Beschleunigung des Zellwachstums eintreten [58]. Davon betroffene Frauen sollten besser mit anderen Substanzen behandelt werden. Es ist bislang aber noch nicht möglich, das Verhalten eines individuellen Tumors in dieser Beziehung vorauszusagen. Ein Hinweis könnte das gleichzeitige Auftreten einer HER2/neu- und AIB1-Expression an einem ER-positivem Tumor sein [59].
Antikörper
Etwa ein Viertel aller Mammakarzinome weisen eine Überexpression des HER2/neu-Rezeptors auf. Der Nachweis dieses Rezeptors steht für einen aggressiven Krankheitsverlauf und eine ungünstige Prognose.
1998 wurde der Wirkstoff Trastuzumab (Handelsname Herceptin®) in den USA und 2000 in der Europäischen Union zunächst für Patientinnen mit metastasiertem Brustkrebs zugelassen. Trastuzumab ist ein monoklonaler Antikörper gegen den Wachstumsrezeptor HER2/neu auf der Zelloberfläche von Krebszellen. Studien ergaben, dass mit dieser sogenannten Targeted-Therapy-Substanz das Risiko eines Rückfalls um etwa 50 % gemindert werden konnte. Seit 2005 deutet sich in klinischen Studien an, dass auch Frauen ohne Metastasen profitieren, wenn sie unter HER2-positivem Brustkrebs leiden. Seit 2006 ist Trastuzumab deshalb auch für die adjuvante Therapie zugelassen.
Therapie des metastasierten Mammakarzinoms
Werden Fernmetastasen nachgewiesen, ist in der Regel keine Heilung mehr möglich. Deshalb richtet sich die Behandlung auf die Lebenszeitverlängerung und den Erhalt einer angemessenen Lebensqualität mit einer langfristigen Stabilisierung der körperlichen und psychischen Verfassung.
Rezidive und Metastasen können operativ entfernt oder mit Strahlentherapie behandelt werden. Trotz der Nebenwirkungen kann unter Umständen auch mit der Verabreichung einer Chemo-, Hormon- oder Antikörpertherapie eine Erhöhung der Lebensqualität erreicht werden.
Wenn der Krebs in seiner Ausbreitung so weit fortgeschritten ist, dass er nicht mehr zurückgedrängt werden kann, richtet sich die Behandlung vor allem auf die Beherrschung von Schmerzen und anderen Krankheitsbeschwerden. Zur palliativen Therapie gehört die psychosoziale Betreuung und eine Schmerzbehandlung, die schnell und vollständig erfolgen sollte und eine frühzeitige und ausreichende Gabe von Opiaten einschließt, siehe WHO-Stufenschema.
Nachsorge
Die Nachsorge der behandelten Patientinnen dauert in der Regel fünf Jahre und richtet sich zumeist nach den Leitlinien der Deutschen Krebsgesellschaft. Auf Nebenwirkungen der Strahlentherapie (Lymphödem, Lungen- oder Herzprobleme), der Chemotherapie (Blutbildveränderungen, Organschäden) und der Hormontherapie (Thrombosen, Osteoporose) muss besonders geachtet werden. Neben der Befragung und klinischen Untersuchung soll in den ersten drei Jahren, da hier die meisten Rezidive auftreten, alle sechs Monate eine Mammographie angefertigt werden. Im vierten und fünften Jahr erfolgt die Mammographie - ebenso wie bei der zweiten, gesunden Brust von Anfang an - jährlich. Zur Verlaufskontrolle in der Blutuntersuchung können die Tumormarker CA 15-3 und CEA bestimmt werden, was allerdings bislang noch nicht in den Richtlinien vorgesehen ist und meistens eher bei konkretem Verdacht der Fall ist.
Für eine einheitliche Qualität bei der Nachbetreuung bieten die deutschen gesetzlichen Krankenkassen seit 2004 das Disease-Management-Programm „Brustkrebs“ an. Die teilnehmenden Ärzte orientieren sich bei der Therapie an den jeweils aktuellen Leitlinien zur Behandlung und Nachsorge des Brustkrebses. Eine Teilnahme ist bei allen Ärzten möglich, die sich diesen qualitätssichernden Programmen angeschlossen haben. Für die Patientinnen bedeutet die Teilnahme an diesem Programm eine Einschränkung der freien Arztwahl.
Einzelnachweise
- ↑ Marilyn A Roubidoux: Breast cancer, male. Emedicine, 2005
- ↑ Robert-Koch-Institut – Krebs in Deutschland 2003–2004: Brustdrüse der Frau
- ↑ Alexander Katalinic, Carmen Bartel: Epidemiologie Mammakarzinom. Universität Lübeck, 2006.
- ↑ WHO/IARC: World Cancer Report. Lyon 2003
- ↑ Backe, Jael: Brustkrebs beim Mann. Dtsch Arztebl 2002; 99(17): A-1168 / B-970 / C-913
- ↑ a b Zusammenstellung der Daten des Statistischen Bundesamtes Deutschland aus den Jahren 2003 bis 2006, Fachserie 12, Reihe 4
- ↑ Deutsche Krebsgesellschaft: Patientinneninformation, 5.6.07 „Familiäre Vorbelastung“
- ↑ Antoniou A, Pharoah PD, Narod S et al. Average risks of breast and ovarian cancer associated with BRCA1 or BRCA2 mutations detected in case Series unselected for family history: a combined analysis of 22 studies. Am J Hum Genet. 72: 1117–30, 2003. PMID: 12677558
- ↑ M. R. Stratton, N. Rahman:The emerging landscape of breast cancer susceptibility. In: Nature Genetics 40/2008, S. 17–22. PMID 18163131
- ↑ Schmutzler R, Meindl A: Das hereditäre Mammakarzinom: Genetik und Prävention. In: Aktuelle Empfehlungen zur Therapie primärer und fortgeschrittener Mammakarzinome (Hrsg. C. Thomssen für die Kommission Mamma der Arbeitsgemeinschaft Gynäkologische Onkologie e. V.). Zuckschwerdt-Verlag, 2007, ISBN 3-88603-916-1
- ↑ Hemminki K, Försti A, Lorenzo Bermejo J. Surveying germline genomic landscape of breast cancer. Breast Cancer Res Treat. 2008. [Epub ahead of print] PMID 18297427
- ↑ Familial breast cancer. Lancet 2001 (358):1389-99, zitiert nach Uta Wagenmann: Auf der Suche nach dem magischen Krebs-Gen. Feitag, 26.4.02
- ↑ Schmutzler, K. u.a.: Familiärer Brust- und Eierstockkrebs: Von der Forschung zur Regelversorgung Dtsch Arztebl 102(50): A-3486, 2005
- ↑ Internet/Behelfsquelle: http://www.europadonna.at/aktuelles/brustkrebs_gen_beratung.html
- ↑ [http://www.aerzteblatt.de/v4/archiv/artikel.asp?id=58821 Siegmund-Schultze N, et al.: Hormontherapie und Brustkrebs: Ein Blick auf aktuelle Datenlage. Dtsch Ärztebl 2008 (105): A-260 / B-234 / C-230]
- ↑ a b c Women’s Health Initiative, zitiert nach Gyne online, 4.6.07
- ↑ U. Ackermann-Liebrich: Stillen als Prävention gegen Brustkrebs. infomed.org, November/Dezember 2002. Nach einer Veröffentlichung in The Lancet, 260/2002, S. 187–95.
- ↑ V. Beral u. a.: Breast cancer and abortion: collaborative reanalysis of data from 53 epidemiological studies, including 83.000 women with breast cancer from 16 countries. In: The Lancet 363/2004, S. 1007–16. PMID 15051280
- ↑ D. H. Brewster u. a.: Risk of breast cancer after miscarriage or induced abortion: a Scottish record linkage case-control study. In: J Epidemiol Community Health 59/2005, S. 283–7. PMID 15767381
- ↑ X. Paoletti, F. Clavel-Chapelon: Induced and spontaneous abortion and breast cancer risk: results from the E3N cohort study. In: Int J Cancer 106/2003, S. 270–6. PMID 12800205
- ↑ G. K. Reeves u. a.: Breast cancer risk in relation to abortion: Results from the EPIC study. In: Int J Cancer 119/2006, S. 1741–5. PMID 16646050
- ↑ Rice S, Whitehead SA: Phytoestrogens and breast cancer –promoters or protectors? Endocrine-Related Cancer 2006 (13):995-1015
- ↑ http://envirocancer.cornell.edu/FactSheet/Diet/fs1.phyto.cfm
- ↑ E. Nekolla: Epidemiologie des strahleninduzierten Mammakarzinoms. Dissertation, LMU München, 2004.
- ↑ F. A. Mettler u. a.: Benefits versus risks from mammography: a critical reassessment. In: Cancer 77/1996, S.903–9. PMID 8608482
- ↑ [Reynolds P, et al.: Active smoking, household passive smoking, and breast cancer: evidence from the California Teachers Study. Journal of the National Cancer Institute 2004 (96):29-37]
- ↑ Sonnenmangel fördert Krebs!, Medical Tribune, 42. Jg., Nr. 23, 8. Juni 2007, S. 21
- ↑ J. M. Lappe u. a.: Vitamin D and calcium supplementation reduces cancer risk: results of a randomized trial. In: The American journal of clinical nutrition 85/2007, S. 1586–91. PMID 17556697
- ↑ a b cancer.org: Detailed Guide: Breast Cancer – What Are the Risk Factors for Breast Cancer? abgerufen am 6. Mai 2008
- ↑ Aiello EJ, et al.: Rate of breast cancer diagnoses among postmenopausal women with self-reported breast symptoms. J American Board of Family Practice 2004 (17):408-15
- ↑ Thomas DB, et al.: Randomized Trial of Breast Self-Examination in Shanghai: Final Results. Journal of the National Cancer Institute 2002 (94):1445-57
- ↑ J. P. Kösters, P. C. Gøtzsche: Regular self-examination or clinical examination for early detection of breast cancer. In: Cochrane Database Syst Rev 2/2003, S. CD003373. PMID 12804462
- ↑ a b [1]
- ↑ Jolie Ringash and the Canadian Task Force on Preventive Health Care: Preventive health care, 2001 update: screening mammography among women aged 40-49 years at average risk of breast cancer.
- ↑ a b S3-Leitlinie „Brustkrebs-Früherkennung“ der dtsch. Fachgesellschaften, 2008
- ↑ http://www.curado.de/krebs/brustkrebs/brustkrebsvorsorge/mr-tomographie-findet-mehr-tumore/
- ↑ http://www.kooperationsgemeinschaft-mammographie.de/cms_upload/pressemitteilungen_43/PM_Start_Brandeburg_2008_01_08.pdf
- ↑ Deutsche Programmrichtlinie für das Mammographiescreening, PDF, siehe S. 43
- ↑ Fabbri S, et al.: Benign breast diseases in breast cancer screening programs in italy 2000–2001. Tumori 90 (2004):547-9
- ↑ Taylor P, Potts HW: Computer aids and human second reading as interventions in screening mammography. Eur J Cancer. 2008;44(6):798-807 Abstract
- ↑ Ultraschall-Vereinbarung gem. §135 Abs. 2 SGB V, Stand 2003
- ↑ a b c d e Interdisziplinäre S3-Leitlinie für die Diagnostik, Therapie und Nachsorge des Mammakarzinoms, 1. Aktualisierung 2008
- ↑ American Society of Clinical Oncology/College of American Pathologists Guideline Recommendations for Human Epidermal Growth Factor Receptor 2 Testing in Breast Cancer. Arch Pathol Lab Med 2007 (131): (PDF)
- ↑ Kongressbericht: St. Gallen Konsensuskonferenz 2007. Im Focus Onkologie 5/2007:48-50 (PDF)
- ↑ Carey LA, et al.: Race, Breast Cancer Subtypes, and Survival in the Carolina Breast Cancer Study. JAMA 2006 (295):2492–2502
- ↑ http://www.krebsgesellschaft.de/news_detail,,,10156.html?markierung=brustzentrum
- ↑ http://www.kvb.de/servlet/PB/menu/1004909/index.html
- ↑ a b c „Anforderungen an strukturierte Behandlungsprogramme für Patientinnen mit Brustkrebs“, Anlage 3 zu §§ 28b bis 28g der Risikostrukturausgleichs-Verordnung nach § 137f SGB Fünftes Buch (V)
- ↑ Travis K: Bernard Fisher reflects on a half-Century’s worth of breast cancer research. Journal of the National Cancer Institute 2005 (97):1636-7
- ↑ a b c d Janni W, et al.: Zertifizierte medizinische Fortbildung: Therapie des primären, invasiven Mammakarzinoms. Dtsch Ärztebl 2005 (102): A-2795 / B-2360 / C-2226 (PDF)
- ↑ Janni W, et al.: Zertifizierte medizinische Fortbildung: Therapie des primären, invasiven Mammakarzinoms. Dtsch Arztebl 2005; 102(41): A-2795 / B-2360 / C-2226
- ↑ Hartsell WF, et al.: Should multicentric disease be an absolute contraindication to the use of breast-conserving therapy? Int J Radiat Oncol Biol Phys. 30 (1994):49-53Abstract
- ↑ Gentilini O, et al.: Conservative surgery in patients with multifocal/multicentric breast cancer. Breast Cancer Res Treat. 2008, E-Publication Abstract
- ↑ Kühn T, et al.: Sentinel-Node-Biopsie beim Mammakarzinom. Geburtsh Frauenheilk 2003 (63):835-40
- ↑ Gonadotoxizität der Chemotherapie http://www.aerzteblatt.de/v4/archiv/artikel.asp?id=52799
- ↑ Vorzeitige Menopause schädigt Gehirn und Nerven
- ↑ von Minckwitz G; for The Breast Commission of the German Gynaecological Oncology Working Group (AGO). Evidence-based treatment of metastatic breast cancer – 2006 recommendations by the AGO Breast Commission. Eur J Cancer. 2006 Nov; 42: 2897-908, 2008. PMID: 17046240
- ↑ Tamoxifen: Hayes DF: Dr. Jekyll and Mr. Hyde? Journal of the National Cancer Institute 2004 (96):895-7
- ↑ Osborne CK, et al.: Role of the estrogen receptor coactivator AIB1 (SRC-3) and HER-2/neu in tamoxifen resistance in breast cancer. Journal of the National Cancer Institute 2003 (95):353-61
Literatur
- Heinrich Schmidt-Matthiesen, Gunther Bastert, Diethelm Wallwiener (Hrsg.): Gynäkologische Onkologie. 7. Auflage. Schattauer Verlag, Stuttgart 2002. ISBN 3-7945-1974-4.
- Orlando Silva, Stefano Zurrida (Hrsg.): Brustkrebs: Diagnostik und Therapie. Urban & Fischer, München 2007. ISBN 3-4372-4260-1.
- Broschüre „Brustkrebs“ der Deutschen Krebsgesellschaft PDF
- Rainer Kürzl: Evidenzbasierte Missverständnisse beim Mammakarzinom. Erkrankungsrisiko und Mortalitätsreduktion. In: Deutsches Ärzteblatt, Köln 2004, 101(36), S. A2387-A2390. ISSN 0012-1207
Weblinks
Linkkatalog zum Thema Brust (Krebs) bei curlie.org (ehemals DMOZ)
- S3-Leitlinie Brustkrebs-Früherkennung der Deutschen Gesellschaft für Senologie und der deutschen Krebshilfe e. V.. In: AWMF online (Stand Februar 2008)
- S3-Leitlinie Diagnostik, Therapie und Nachsorge des Mammakarzinoms der Frau der Deutschen Gesellschaft für Gynäkologie und Geburtshilfe und der Deutsche Krebsgesellschaft e. V.. In: AWMF online (Stand 2008)
- Brustkrebs - die blauen Ratgeber Nr. 2 der Deutschen Krebshilfe.
- Krebsinformationsdienst am DKFZ Heidelberg, Seite „Brustkrebs“
- Deutsche Gesellschaft für Senologie
- Breast Cancer Action Germany: Übersicht der Brustkrebs-Leitlinien
- Brustkrebs beim Deutschen Grünen Kreuz e.V.
